Влияние встряхивания на фармацевтические препараты, проанализированное с помощью метода испарившихся капель
Перевод статьи Kokornaczyk MO, Würtenberger S, Baumgartner S. Impact of succussion on pharmaceutical preparations analyzed by means of patterns from evaporated droplets. Sci Rep. 2020 Jan 17;10(1):570. doi: 10.1038/s41598-019-57009-2. PMID: 31953459; PMCID: PMC6969209. Резюме Целью настоящего исследования было изучение того, можно ли с помощью паттернов, полученных при испарении капель фармацевтических препаратов, определить, проводилось или нет встряхивание таких препаратов в процессе приготовления. Для этой цели пять фармацевтических препаратов (Echinacea 10-2 (D2), Baptisia 10-3 (D4) , Baptisia 10-4 (D4) , Luffa 10-4 (D4) и Spongia 10-6 (D6) ) были приготовлены в соответствии с руководящими принципами Европейской фармакопеи по производству гомеопатических средств, в трех вариантах каждый: с различным количеством встряхиваний (i) 100, (ii) 10 (встряхиваемые образцы) и (iii) ноль (мягко перемешанный, невстряхиваемый образец). Стабильность системы изучалась с помощью систематических экспериментов с положительным контролем. Паттерны оценивались с помощью компьютерного анализа изображений с учетом распределения уровней серого, текстуры и фрактальности. Для всех исследованных фармацевтических препаратов были обнаружены значительные различия между встряхиваемыми и мягко перемешанными образцами; при этом все три образца (приготовленные с 100, 10 и нулевым встряхиванием) могли быть точно идентифицированы для Luffa 10 -4 и Spongia 10 -6 по одному параметру оценки изображения каждый. Контрольные эксперименты показали разумную стабильность экспериментальной установки. Введение Известно, что встряхивание раствора может оказывать влияние на содержащиеся в нем белки 1 , 2 ; введение пузырьков воздуха в раствор 3 , а также действие разделяющих сил может вызвать процессы окисления и агрегацию этих молекул 1 , 4 , 5 , 6 . Даже случайное падение флакона, как сообщается, модифицирует некоторые белки в суспензии 2 . В фармацевтических препаратах в некоторых случаях встряхивание и вызванная им агрегация белков могут влиять на их свойства; поэтому разработка мер, смягчающих влияние встряхивания, таких как, например, разработка новых покрытий для предварительно заполненных шприцев, важна и рассматривается в недавних исследованиях 6 . Влияние перемешивания на жидкие фармацевтические продукты было исследовано с помощью различных аналитических подходов, включая методы анализа образования частиц (микропотоковая визуализация, динамическое рассеяние света, метод затемнения света), деградации белка (эксклюзионная хроматография, триптическое расщепление/ВЭЖХ), образования свободных радикалов (анализ гидроксифенилфлуоресцеина) и динамики потока, происходящего во время перемешивания (высокоскоростная визуализация). Кроме того, для оценки характеристик перемешиваемых образцов были применены различные методы спектроскопии (флуоресцентная спектроскопия, инфракрасная спектроскопия с преобразованием Фурье) и калориметрические методы (дифференциальная сканирующая калориметрия) 1 , 2 , 3 , 4 , 5 , 6. Здесь мы впервые предлагаем применить метод испарения капель (DEM) для оценки характеристик перемешиваемых фармацевтических препаратов сравнительно быстрым и комплексным образом. В последнее время методы, основанные на испарении капель, находят применение в различных областях науки и техники, например, в производстве новых материалов, микроэлектронике, струйной печати, технологиях нанесения покрытий, производстве биопроб, конденсации растворенных веществ 7 , 8 , 9 , а также в аналитических целях. Среди аналитических приложений DEM наиболее изученным является медицинская диагностика 9 , 10 . Он основан на идее, что в случае некоторых заболеваний паттерны, образующиеся в высушенных каплях некоторых определенных телесных жидкостей (например, крови, сыворотки, слез, пота), будут различаться в зависимости от того, была ли жидкость взята у больного или здорового донора, поскольку болезнь определенным образом изменяет состав жидкости. В предыдущем исследовании 11 мы предложили DEM в качестве инструмента для феноменологической, многофакторной характеристики фармацевтических препаратов в диапазоне низких разбавлений (от 10−2 до 10−6 ) . Соответствующая экспериментальная методика состоит в испарении капель разбавленных фармацевтических препаратов в контролируемых условиях, последовательном осмотре структур, сформированных в остатках капель, под оптическим микроскопом с темным полем и компьютерной оценкой изображений. В настоящем исследовании были проведены дальнейшие исследования с помощью того же экспериментального протокола, чтобы определить, возможно ли «визуализировать» посредством формирования самоорганизующихся структур какие-либо различия между встряхиваемыми и невстряхиваемыми образцами; и, кроме того, покажет ли число выполненных встряхиваний (N S ) какое-либо влияние на структуры. Мы решили исследовать влияние встряхивания на фармацевтические продукты в соответствии с рекомендациями для гомеопатических препаратов, поскольку применение встряхивания является обязательной процедурой согласно Европейской Фармакопее 12. Процедура приготовления гомеопатических фармацевтических препаратов из жидкой субстанции состоит из последовательных этапов разбавления (в определенной пропорции разбавления), за каждым из которых следует встряхивание (т. е. придание жидкости какого-либо движения, в основном энергичного). Выбор фармацевтических препаратов основывался как на их структурообразующих свойствах (предпочтительно было выбрано образование дендритов) 11 , так и на наличие этих компонентов в составе комплексного препарата Sinusitis Hevert SL (препарат для лечения хронического ринита) . Мы исследовали пять различных фармацевтических препаратов растительного ( Echinacea 10−2 , Baptisia 10−3 , Baptisia 10−4 , Luffa 10−4 ) и животного ( Spongia 10−6 ) происхождения, приготовленных в трех различных вариантах каждый: встряхиваемые путем нанесения 100 или 10 ударов (встряхиваемые образцы) или без встряхивания (только осторожно перемешанный контрольный образец). Применяемая техника перемешивания была принята из производственного протокола, используемого фармацевтической компанией Hevert-Arzneimittel GmbH & Co. Важнейшим моментом в аналитических методах, включающих изображения в качестве основного экспериментального результата, является оценка изображения и выбор надлежащих инструментов оценки и критериев или параметров оценки. Во многих исследованиях изображения DEM анализировались исключительно с помощью визуальной оценки 13 ; несмотря на то, что человеческий глаз является наиболее точным инструментом для распознавания форм, визуальная оценка узоров может быть субъективной и также сильно ограничивает размер базы данных изображений, подлежащих оценке. В предыдущих исследованиях мы ввели компьютерное измерение нескольких параметров оценки изображения, характеризующих изображения с точки зрения их распределения уровня серого, текстуры 11 и фрактальности 14 . Параметр распределения уровня серого измеряет яркость изображения 15 , которая в случае изображений DEM предоставляет информацию о размере структур, толщине ветвей и их яркости. Размер структуры можно оценить более точно с помощью параметра пиксель переднего плана , который измеряет площадь структуры 16 , однако не имеет доступа к яркости. Параметр текстура является атрибутом матрицы совместного появления уровней серого, измеряющим, как часто различные значения яркости пикселей встречаются на изображении; в частности, текстура характеризует неоднородность распределения значений яркости и описывает, таким образом, беспорядок изображения 17 . Наконец, параметр локальной связанной фрактальной размерности измеряет фрактальную размерность структур в предопределенном диапазоне размеров и оценивает, таким образом, сложность структур 16 . Кроме того, в настоящем исследовании мы добавили параметр лакунарности , дополнительную меру к фрактальной размерности, характеризующую зазоры между элементами структуры 16 и предоставляющую, таким образом, информацию о плотности структуры. Методы Изготовление фармацевтических препаратов в разведении 10−1 Echinacea 10−1 , Baptisia 10−1 , Luffa 10−1 и Spongia 10−1 были произведены компанией Hevert-Arzneimittel GmbH & Co. KG (Нуссбаум, Германия) в соответствии с Европейской фармакопеей, Гомеопатические препараты 12. В частности, Baptisia 10−1 и Echinacea 10−1 были приготовлены методом 1.1.5 ( т.е. первое разведение в соотношении 3 :7), Luffa 10−1 — методом 1.1.8 (т.е. первое разведение в соотношении 1 :9), а Spongia 10−1 — методом 1.1.9 (т.е. первое разведение в соотношении 2:8) . Дизайн исследования Эксперименты проводились в лабораториях Общества по исследованию рака (Арлесхайм, Швейцария). Как показано на рис. 2, исследование состояло из основных экспериментов и полных систематических экспериментов с положительным контролем. Основные эксперименты проводились на пяти фармацевтических препаратах ( Echinacea 10−2, Baptisia 10−3 , Baptisia 10−4 , Luffa 10−4 и Spongia 10−6 ) , приготовленных из разведений 10−1 путем применения различного количества встряхиваний (N S = 100, 10 или 0 ). Эти три варианта данного гомеопатического препарата анализировались в одном экспериментальном цикле, состоящем из двенадцати слайдов с нанесенными на них каплями (рис. 3 ) . Для каждого фармацевтического препарата использовалось четыре слайда. Слайды были распределены в климатизированной камере в соответствии с квазирандомизированным дизайном. Каждый основной эксперимент имел соответствующий систематический положительный контрольный эксперимент, где анализируемый образец был подготовлен три раза с N S = 10 и проанализирован в соответствии с тем же квазирандомизационным дизайном, что и в основном эксперименте. Все эксперименты были независимо повторены три раза. Подготовка фармацевтических препаратов к анализу 0,8 г фармацевтического препарата в разведении 10−1 взвешивали и помещали в стерильный стеклянный цилиндр (SBR-ET, Mix Cyl. 10 ml, B; Brand GmbH + CO KG, Wertheim, Германия) с пробкой (нецелевой объем 13 мл); затем добавляли 7,2 мл очищенной воды в соответствии с Pharm. Eur. 9.4 12 («очищенная вода оптом», X-SEPTRON LINE 10 VAL, BWT AQUA AG, Aesch, Швейцария) для достижения разбавления 1:9. Цилиндр плотно закрывали; вручную наносили 10 или 100 встряхивающих ударов. Движение для достижения встряхивания выполняли в воздухе без удара о твердое основание. Для невстряхиваемых образцов содержимое цилиндра перемешивали стеклянной мешалкой круговыми движениями, чтобы не образовывалась пена. После оседания пены в препаратах N S = 10 и 100 цилиндры снова открывали и брали 0,8 мл раствора для приготовления следующего разбавления, как описано ранее. Таким образом, были получены три варианта (N S = 100, 10, 0) каждого препарата (Echinacea 10−2, Baptisia 10−3, Baptisia 10−4 , Luffa 10−4 и Spongia 10−6 ) . Все образцы готовили свежими для каждого эксперимента . Образцы не были слепыми . Метод испарения капель Предметные стекла микроскопа (76 × 26 мм, предварительно очищенные, обрезанные края; Thermo Scientific, Gerhard Menzel BV & Co. KG, Брауншвейг, Германия) обезжиривали, промывая их жидкостью для мытья посуды, затем тщательно ополаскивали горячей водопроводной водой и помещали в 4 последовательные ванны с очищенной водой. Каждое предметное стекло вытирали насухо лабораторным салфеткой (KIMTECH science, Kimberly-Clark Professional, Розуэлл, Канада) непосредственно перед нанесением капель. Капли тестируемого фармацевтического препарата объемом 3 мкл наносили на предметные стекла двумя параллельными рядами, по 7 капель в ряд, с помощью микропипетки емкостью 20 мкл (Eppendorf Research Plus, Эппендорф, Гамбург, Германия). Выпаривание проводилось в инкубаторе (KBF 720, охлаждаемый инкубатор с контролируемой системой влажности, WTB Binder Labortechnik GmbH, Туттинген, Германия) с внутренней камерой из плексигласа с полупроницаемой крышкой, размещенной на вибропоглощающей основе. Предметные стекла микроскопа с каплями помещались во внутреннюю камеру и оставлялись для испарения при температуре 26 °C и относительной влажности 44% в течение 1 часа. Распределение предметных стекол внутри камеры следовало квазирандомизированному плану, чтобы обеспечить равномерное расположение образцов в рядах (рис. 2 ). Фотографирование узоров Остатки капель были исследованы и сфотографированы в темном поле при увеличении 100× с использованием оптического микроскопа (Zeiss Lab.A1; Carl Zeiss Microscopy GmbH, Йена, Германия) с прикрепленной камерой (Moticam 5.0 MP; CMOS; Motic Electric Group Co., Ltd, Сямынь, Китай). Капли с нарушенной кристаллизацией из-за присутствия загрязняющих частиц или из-за краевых эффектов на предметном стекле не рассматривались. За один эксперимент (один запуск камеры, рис. 3 ) было подготовлено 168 капель (14 капель x 12 предметных стекол). Для Echinacea 10−2 три основных эксперимента дали 399 оцениваемых изображений остатков капель, а три эксперимента с положительным контролем — 406 изображений (399/406); для Baptisia 10−3 415/387; для Baptisia 10−4 461/386; для Luffa 10−4 410/413; и для Spongia 10−6 395/354 , что в общей сложности дало 4'026 изображений . Изображения были сохранены в формате jpeg (2592 × 1944 пикселей ) . В случае Echinacea 10−2 , Baptisia 10−3 , Luffa 10−4 и Spongia 10−6 изображения с увеличением 100X включали всю структуру, сформированную внутри капли; тогда как в случае Baptisia 10−4 были включены только выбранные части структуры , выбранные экспериментатором на основе плотности и интенсивности форм. Компьютеризированная оценка рисунка Анализ изображений проводился с помощью программного обеспечения ImageJ (v. 1.50b) 27 с плагинами GLCM Texture 28 и Frac-Lac 16. Все 100-кратные изображения подвергались извлечению фона с помощью скользящего параболоида с радиусом катящегося шара, установленным на 50 пикселей, что обеспечивало одинаковый фон во всей базе данных изображений. Последовательно изображения анализировались (i) на предмет распределения уровней серого, (ii) после преобразования в 8-битный тип, путем запуска алгоритма GLCM (с учетом расстояний между парами пикселей в 4 пикселя и углов в 90°), на предмет текстуры (параметр энтропия ), и (iii) после преобразования в двоичный формат, с помощью инструмента DLC Frac-Lac с методом масштабирования нечетных размеров и ограничениями по размеру для серии калибра сетки минимум 4 и максимум 40 пикселей, на предмет размера структур (параметр пиксели переднего плана) , сложности (параметр локальная связанная фрактальная размерность ), и характеристики зазоров между элементами структуры (параметр лакунарность ). После преобразования в двоичный формат 68 изображений Echinacea 10 −2 не могли быть использованы из-за слишком плотной сети разветвления и были исключены из анализа фрактальности. Тогда как в случае Baptisia 10−3 и Luffa 10−4 фрактальный анализ проводился на изображениях, уменьшенных до размера 500 × 375 пикселей . Статистический анализ Данные, полученные в результате компьютерного анализа изображений, были проанализированы с помощью двухфакторного дисперсионного анализа (CoStat, v. 6.311) (CoHort Software, Монтерей, США) при альфа = 0,05 с независимыми факторами: числом встряхиваний (N S ) и днем или строкой и столбцом . В статистическую модель был включен член взаимодействия между независимыми факторами для оценки стабильности и воспроизводимости. Распределение данных проверялось путем визуального осмотра. Небольшие отклонения от нормальности были несущественными из-за центральной предельной теоремы. Наборы данных с большими отклонениями от нормальности были логарифмически преобразованы (log10); Всего было преобразовано 18 наборов данных ( Echinacea 10 −2 основное/контрольное исследование: FP, LAC/FP, LAC; Baptisia 10 −3 : FP, LAC/FP, LAC; Baptisia 10 −4 : GLD, FP/GLD, FP; Luffa 10 −4 : FP/FP; Spongia 10 −6 : GLD, FP/GLD, FP). Глобальная значимость определялась с помощью F-тестов. Парное сравнение средних значений выполнялось с двухсторонним защищенным тестом Фишера на наименьшую значимую разницу (парные сравнения оценивались только в том случае, если глобальный F-тест был значимым при p < 0,05). Эта процедура обеспечивает хорошую защиту от ошибок типа I, а также типа II и, таким образом, хорошо балансирует между ложноположительными и ложноотрицательными выводами 29 . Результаты преобразованных наборов данных были обратно преобразованы для представления. Результаты Качественное описание закономерностей При анализе с помощью DEM пять исследованных здесь фармацевтических препаратов создали визуально узнаваемые и легко идентифицируемые узоры (рис. 1 ). В случае Echinacea 10 −2 , Baptisia 10 −3 и Luffa 10 −4 узоры состояли из дендритных фракталоподобных структур, расположенных в центре капли. Echinacea 10 −2 создала большие, плотные сети очень тонких разветвлений, Baptisia 10 −3 создала довольно маленькие, округлые структуры, а Luffa 10 −4 структуры, состоящие из довольно немногих и толстых дендритов. Baptisia 10 −4 создала неспецифические узоры, состоящие из линий, мазков и, в некоторых случаях, отдельных дендритов, распределенных по всей капле. В то время как Spongia 10−6 создавала от одной до пяти заполненных волнистых форм на каплю, характеризующихся вогнутой и выпуклой сторонами, расположенных рядом друг с другом и обращенных друг к другу вогнутыми сторонами.
 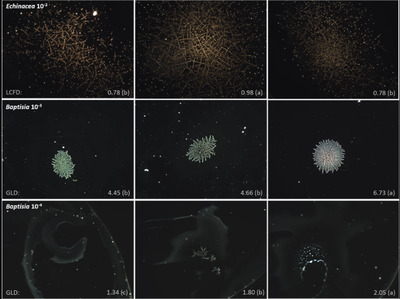
Примеры узоров, образованных при испарении капель жидких фармацевтических препаратов; остатки капель, высушенные на стеклянной подложке, были сфотографированы с помощью темнопольной микроскопии при увеличении 100×. В строках представлены узоры, полученные из Echinacea 10−2 , Baptisia 10−3 , Baptisia 10−4 , Luffa 10−4 и Spongia 10−6 , тогда как в столбцах варьируется способ приготовления , заключающийся в выполнении вертикальных встряхивающих ударов (N S = 100 , 10 или 0). Примеры узоров получены из основных экспериментов (ср. рис. 2 ) и были выбраны на основе значения параметра анализа изображения ( распределение уровней серого (GLD), лакунарность (LAC) и локальная связанная фрактальная размерность (LCFD)), которое близко к среднему значению соответствующего параметра. Различные буквенные коды (a, b, c) существенно различаются (p < 0,05). В целом, во всех фармацевтических препаратах влияние встряхивания на узоры было визуально заметно в той или иной, но довольно небольшой степени, и, по-видимому, приводило к снижению упорядоченности структуры. Компьютеризированная оценка рисунка Результаты компьютерной оценки паттернов фармацевтических препаратов, полученных с различным числом встряхиваний (N S = 100, 10 , 0), соответствующие систематические эксперименты с положительным контролем и F - тесты дисперсионного анализа для Echinacea 10−2 , Baptisia 10−3 , Baptisia 10−4 , Luffa 10−4 и Spongia 10−6 показаны в таблицах 1–5 соответственно . Эхинацея 10 −2 В случае эхинацеи 10−2 (таблица 1 ) применение встряхивания значительно увеличило параметры оценки паттерна распределение уровня серого (GLD) и энтропию (для N S = 10, 100). Также параметры фрактальности локально связанная фрактальная размерность (LCFD) и лакунарность увеличились после встряхивания, однако LCFD только для N S = 10 и лакунарность только для N S = 100. Все проведенные систематические контрольные эксперименты не выявили никакой значимости между группами рандомизации по основным эффектам. Баптизия 10 −3 Как показано в Таблице 2 , встряхиваемые образцы Baptisia 10−3 (N S = 100, 10) характеризовались значительно более низкими значениями GLD, энтропии , FP и LCFD по сравнению с невстряхиваемыми образцами, тогда как лакунарность была значительно выше. Систематические контрольные эксперименты дали значительный основной эффект для параметров FP и энтропии ; остальные три параметра анализа изображений не показали статистически значимых различий между группами рандомизации для основных эффектов. Таким образом, результат основных экспериментов относительно FP и энтропии может быть искажен из-за градиентов камеры (см. ниже) и был исключен из дальнейшей оценки. Баптизия 10 −4 В случае Baptisia 10−4 параметр FP мог значительно различаться между всеми образцами (N S = 0, 10, 100); тогда как параметры GLD, энтропия, LCFD и лакунарность различались между встряхиваемыми (N S = 10, 100) и невстряхиваемыми (N S = 0) образцами (таблица 3 ). Систематические контрольные эксперименты дали значительный основной эффект для параметра FP; остальные четыре параметра анализа изображений не показали статистически значимых различий между группами рандомизации для основных эффектов. Таким образом, результат основных экспериментов относительно FP может быть искажен из-за градиентов камеры (см. ниже) и был исключен из дальнейшей оценки. Люффа 10 −4 Для Luffa 10−4 GLD, FP и LCFD значительно снизились в встряхиваемых образцах, тогда как лакунарность увеличилась (таблица 4 ). Параметр лакунарности значительно дифференцировал все образцы (N S = 100, 10 и 0); тогда как параметр энтропии не показал никакой значимости между образцами в основных экспериментах. Ни один из проведенных систематических контрольных экспериментов не выявил значимых основных эффектов между группами рандомизации. Спонгии 10 −6 В случае Spongia 10−6 (таблица 5 ) параметр LCFD дифференцировал все образцы и ранжировал их в порядке N S 0 > 100 > 10; тогда как лакунарность дала значительно более высокие значения только для образца N S = 10. Параметр энтропия дифференцировал встряхиваемые образцы (N S = 100, 10) от невстряхиваемых. Параметры GLD и FP не дифференцировали образцы.Ни один из проведенных систематических контрольных экспериментов не выявил значимых основных эффектов между группами рандомизации. Влияние суккуссии на картины DEM Для того чтобы суммировать экспериментальные результаты, в Таблице 6 мы считали релевантными только те случаи, когда соответствующий параметр анализа изображения был экспериментально стабилен, что означает, что (i) систематические эксперименты с положительным контролем не были значимыми, и (ii) в F-тесте дисперсионного анализа основных экспериментов значение F для фактора N S было выше, чем значение F для взаимодействия N S и дня . Это означает, что 16 из 25 комбинаций параметра/препарата были сохранены. В целом, мы наблюдали значимые различия по крайней мере для одного образца (N S = 100 или 10) по сравнению с N S = 0 во всех проанализированных сравнениях (100%, 16/16). В большинстве случаев (68,75% сравнений, 11/16) разница была между встряхиваемыми (N S = 100, 10) и невстряхиваемыми (N S = 0) образцами, без дифференциации между встряхиваемыми образцами. В 12,50% (2/16) случаев все образцы (N S = 100, 10 и 0) могли быть значительно дифференцированы; в 12,50% (2/16) случаев образец N S = 10 отличался от двух других (N S = 0, 100); и в одном случае (6,25%, 1/16) выборка N S = 100 отличалась от двух других (N S = 0, 10). Обобщая, можно сказать, что GLD не показал общего направления влияния встряхивания на паттерны; тогда как в паттернах из встряхнутых образцов параметр оценки паттерна энтропия увеличился, а LCFD уменьшился. Лакунарность была единственным параметром, показывающим значимые различия для всех фармацевтических препаратов и в целом показывающим повышенные значения в встряхнутых образцах. FP дифференцировал образцы только в случае одного средства ( Luffa 10−4 ) . Обсуждение Результаты настоящего исследования показывают, что во всех пяти проанализированных фармацевтических препаратах удары встряхивания, применяемые в процессе производства, значительно повлияли на паттерны DEM. Можно резюмировать, что встряхивание вызвало образование структур, характеризующихся большей неупорядоченностью (параметр энтропия ) и меньшей сложностью (параметр локальная связанная фрактальная размерность ), в то же время увеличивая зазоры между элементами структуры (параметр лакунарность ). В случае двух препаратов ( Luffa 10−4 и Spongia 10−6 ) можно было найти значительные различия между всеми образцами (NS = 0, 10 и 100 ). Выбранные здесь параметры уже применялись при структурном анализе паттернов, образованных в ходе фазового перехода жидких фармацевтических препаратов11 ; более того, поверхности сырья, присутствующие в фармацевтических растираниях, также были проанализированы с помощью фрактальной размерности18 . Паттерны DEM в анализируемом диапазоне разбавления 10−2 -10−6 являются в первую очередь определяются функцией сухого остатка растворенного вещества. Различия, обнаруженные между паттернами встряхиваемых и не встряхиваемых образцов, могут быть связаны с агрегацией крупных молекул, вызванной встряхиванием 2 , 5 , или, в случае Spongia 10−6 (состоящей только из минеральных веществ, поскольку губка обжаривается), за счет введения пузырьков воздуха и/или образования частиц 2 . В то время как паттерны Echinacea 10 −2 , Baptisia 10 −3 , Luffa 10 −4 и Spongia 10 −6 были сконцентрированы в центральной части остатка капли и полностью соответствовали сфотографированному в 100-кратном увеличении изображению, в случае Baptisia 10 −4 структуры были довольно неспецифичны и распределены почти равномерно по всему остатку капли (рис. 1 ). Чтобы сохранить одинаковое увеличение во всей серии экспериментов, часть для фотографирования выбиралась экспериментатором (на основе визуальной проверки паттерна выбиралась часть с наиболее очевидными структурами). Поэтому результаты Baptisia 10 −4 могут быть обременены определенным смещением; которое в будущих экспериментах может быть преодолено путем адаптации экспериментальной модели. Анализ систематических экспериментов с положительным контролем с помощью F-теста дисперсионного анализа с независимыми факторами строки и столбца показал, что фактор строки значительно повлиял на 14/25 параметров (таблица 7 ). В большинстве случаев (13/14) эта систематическая ошибка могла быть успешно устранена (таблицы 1–5 ) путем применения квазирандомизационного дизайна, заключающегося в рандомизации образцов только в пределах столбцов, сохраняя одновременно равномерное распределение образцов в пределах строк. Однако в будущих экспериментах следует стремиться к лучшей изоляции внутренней камеры для улучшения однородности условий испарения. Влияние фактора дня было значительным в большинстве представленных здесь экспериментов (24/25 дифференциация и 23/25 контрольные эксперименты) (таблицы 1 – 5 ). Значительное влияние дня эксперимента было отмечено во многих предыдущих исследованиях, касающихся методов, основанных на формировании паттернов, вызванных фазовым переходом 11 , 13 , 14 , 19 , 20 , 21 , 22 . Этот факт может быть обусловлен некоторыми ежедневными изменениями в производительности эксперимента или экспериментальных условиях; или другими пока неизвестными и неконтролируемыми влияниями. В заключение мы отметили, что применение метода испарения капель к фармацевтическим препаратам привело к созданию закономерностей, выявляющих различия в параметрах распределения уровня серого, текстуры и фрактальности в зависимости от применения встряхивания и количества ударов встряхивания, выполненных во время фармацевтической обработки. В настоящем исследовании мы проводили встряхивание, встряхивая цилиндр с раствором вручную свободно в воздухе, при этом цилиндр был заполнен примерно на 2/3 его объема. Этот вид встряхивания является обычной процедурой, применяемой многими производителями фармацевтических препаратов, однако он не полностью стандартизирован и может различаться по скорости и динамике при выполнении разными людьми. Дальнейшие эксперименты DEM должны быть проведены для сравнения воздействия различных методов встряхивания, учитывая, помимо количества выполненных движений, также их интенсивность и тип движения. Представленный здесь экспериментальный протокол может представлять собой довольно экономичный и быстрый инструмент для исследования влияния перемешивания на растворы, что имеет большое значение для производства и распределения фармацевтических препаратов в целом и которое рассматривается во многих недавних исследованиях. В частности, он может служить для сравнения роли нескольких факторов, известных как критические для свойств раствора, таких как, например, тип индуцированного потока (например, хаотический против упорядоченного, вихревого) 2 , 3 , 23 , различные поверхности и покрытия стенок реципиента 24 , 25 и различные объемы свободного пространства 2 , 26 . DEM может применяться в качестве альтернативы или дополнения к устоявшимся аналитическим методам, используемым для характеристики встряхиваемых растворов, таким как, в частности , микропотоковая визуализация, динамическое рассеяние света, метод затемнения света (служащий для анализа образования частиц), гель-хроматография и триптическое переваривание/ВЭЖХ (для изучения агрегации белков), анализ гидроксифенилфлуоресцеина (анализ образования свободных радикалов) и флуоресцентная спектроскопия, инфракрасная спектроскопия с преобразованием Фурье и дифференциальная сканирующая калориметрия (для дальнейшей характеристики состава раствора и термодинамических характеристик) 1 , 2 , 3 , 4 , 5 , 6 . Следует провести сравнительные исследования DEM с этими методами, чтобы лучше охарактеризовать паттерны DEM с точки зрения специфических свойств раствора. Кроме того, необходимы исследования возможной связи между паттернами и биологической эффективностью. Список литературы 1. Kiese S, et al. Shaken, not stirred: mechanical stress testing of an IgG1 antibody. J. Pharm. Sci. 2008;97(10):4347–66. doi: 10.1002/jps.21328. 2. Randolph TW, et al. Do Not Drop: Mechanical Shock in Vials Causes Cavitation, Protein Aggregation, and Particle Formation. J. Pharm. Sci. 2015;104:602–11. doi: 10.1002/jps.24259. 3. Kelkar MA, Gogate PR, Pandit AB. Process intensification using cavitation: optimization of oxidation conditions for synthesis of sulfone. Ultrason Sonochem. 2006;13:523–8. doi: 10.1016/j.ultsonch.2005.10.003. 4. Thomas CR, Geer D. Effects of shear on proteins in solution. Biotechnol. Lett. 2011;33:443–56. doi: 10.1007/s10529-010-0469-4. 5. Jayaraman M, Buck PM, Ignatius AA, King KR, Wang W. Agitation-induced aggregation and subvisible particulate formation in model proteins. Eur. J. Pharm. Biopharm. 2014;87:299–309. doi: 10.1016/j.ejpb.2014.01.004. 6. Gerhardt A, et al. Protein aggregation and particle formation in prefilled glass Syringes. J. Pharm. Sci. 2014;103:1601–1612. doi: 10.1002/jps.23973. 7. Mampallil D, Eral HB. A review on suppression and utilization of the coffee-ring effect. Adv. Colloid Interface Sci. 2018;252:38–54. doi: 10.1016/j.cis.2017.12.008. 8. Bhardwaj R, Fang X, Somasundaran P, Attinger D. Self-assembly of colloidal particles from evaporating droplets: role of DLVO interactions and proposition of a phase diagram. Langmuir. 2010;26(11):7833–7842. doi: 10.1021/la9047227. 9. Misyura SY. Evaporation of a sessile water drop and a drop of aqueous salt solution. Sci. Rep. 2017;7:14759. doi: 10.1038/s41598-017-15175-1. [Google Scholar] 10. Chen R, Zhang L, Zang D, Shen W. Blood drop patterns: formation and application. Adv. Colloid Interface Sci. 2016;23:1–14. doi: 10.1016/j.cis.2016.01.008. 11. Kokornaczyk, M.O., Würtenberger, S. & Baumgartner, S. Phenomenological characterization of homeopathic preparations in low potency levels by means of pattern formation in evaporating droplets. Homeopathy, 10.1055/s-0038-1676325 (2018). 12. European Pharmacopoeia, Ninth Edition, Supplement 9.4. EDQM, editor. Stasbourg, France: Council of Europe; 2017. 13. Kokornaczyk MO, Scherr C, Baumgartner S. Phase-transition-induced pattern formation applied to basic research on homeopathy: a systematic review. Homeopathy. 2018;107:181–188. doi: 10.1055/s-0038-1649521. 14. Kokornaczyk MO, et al. Self-organized crystallization patterns from evaporating droplets of common wheat grain leakages as a potential tool for quality analysis. ScientificWorldJournal. 2011;11:1712–25. doi: 10.1100/2011/937149. 15. Ferreira, T., Rasband, W.S. ImageJ User Guide — IJ 1.46. From: imagej.nih.gov/ij/docs/guide/. (2010–2012). 16. Karperien, A. FracLac for ImageJ, http://rsb.info.nih.gov/ij/plugins/fraclac/FLHelp/Introduction.htm (1999-2013). 17. Eichkitz CG, Amtmann J, Schreilechner MG. Calculation of grey level co-occurance matix-based seismic attributes in three dimensions. Computers & Geosciences. 2013;60:176–183. doi: 10.1016/j.cageo.2013.07.006. 18. Kalliantas D, Kassalia ME, Karigianni CHS. Trituration and fractal dimension in homeopathic Pharmacopoeia. Pharm Anal Acta. 2017;8:554. 19. Kokornaczyk MO, et al. Droplet evaporation method as a new potential approach for highlighting the effectiveness of ultra high dilutions. Complement Ther Med. 2014;22:333–40. doi: 10.1016/j.ctim.2014.02.005. 20. Kokornaczyk MO, Baumgartner S, Betti L. Polycrystalline structures formed in evaporating droplets as a parameter to test the action of Zincum metallicum 30c in a wheat seed model. Homeopathy. 2016;105:173–9. doi: 10.1016/j.homp.2015.10.002. 21. Betti L, et al. Number of succussion strokes affects effectiveness of ultra-high-diluted arsenic on in vitro wheat germination and polycrystalline structures obtained by droplet evaporation method. Homeopathy. 2017;106:47–54. doi: 10.1016/j.homp.2016.12.001. 22. Baumgartner, S., Doesburg, P., Scherr, C. & Andersen, J.O. Development of a biocrystallisation assay for examining effects of homeopathic preparations using cress seedlings. Evid Based Complement Alternat Med. 2012, 125945; 10.1155/E.pub (2012). 23. Wiesbauer J, Cardinale M, Nidetzky B. Shaking and stirring: Comparison of controlled laboratory stress conditions applied to the human growth hormone. Process Biochem. 2013;48:33–40. doi: 10.1016/j.procbio.2012.11.007. 24. Waxman, L. & Vilivam, V. A comparison of protein stability in prefillable syringes made of glass and plastic. PDA J. Pharm. Sci. Technol. 71, 10.5731/pdajpst.2016.007146 (2017). 25. Gerhardt, A., Nguyen, B., Lewus, R., Carpenter, J. & Randolph, T. Effect of the siliconization method on particle generation in a monoclonal antibody formulation in pre-filled syringes. J. Pharm. Sci. 10410.1002/jps.24387 (2015). 26. Uchino T, et al. Reconstitution of L-Asparaginase in siliconized syringes with shaking and headspace air induces protein aggregation. Chem Pharm Bull (Tokyo). 2015;63:770–779. doi: 10.1248/cpb.c15-00242. 27. Schneider CA, Rasband WS, Eliceiri KW. NIH Image to ImageJ: 25 years of image analysis. Nature methods. 2012;9(7):671–675. doi: 10.1038/nmeth.2089. [PMC free article] 28. Cabrera, J. E. GLCM texture analyzer. https://imagej.nih.gov/ij/plugins/texture.html (2003–2006). 29. Carmer SG, Swanson MR. An evaluation of ten pairwise multiple comparison procedures by Monte Carlo Methods. J. Am. Stat. Assoc. 1973;68:66–74. doi: 10.1080/01621459.1973.10481335. Источник: https://www.nature.com/articles/s41598-019-57009-2 | |
| Просмотров: 340 | |
