Лечение алиментарной лимфомы у кошки (Felis catus) с помощью инъекционной гомеопатии - отчет о случае
| Перевод статьи de Carvalho AC, Valle ACV (2021) Treatment of Alimentary Lymphoma in Cat (Felis catus) by Injectable Homeopathy – Case Report. Integr J Vet Biosci Volume 5(2): 1–6. DOI: 10.31038/IJVB.2021521
Резюме Лимфома – неоплазия, наиболее часто встречающаяся у кошек, с различными формами проявления заболевания. Среди различных типов лимфом Кишечная (алиментарная) лимфома считается наиболее распространенной в онкологической клинике этого вида, достигая 50% всех диагностируемых лимфом. В целом это заболевание может быть лимфоцитарным или лимфобластным, различаясь по острому или хроническому характеру проявления. В-клеточная лимфобластная лимфома, по-видимому, является наиболее тяжелой и трудной для лечения. Терапией выбора при этом заболевании является традиционная химиотерапия. Однако этот тип протокола приводит к определенной степени токсичности, что часто делает часто лечения невозможным. В этом контексте дополнительные методы лечения выделяются отсутствием побочных эффектов. Поэтому потенцированный препарат Viscum album становится отличной альтернативой этому терапевтическому подходу. Целью данного исследования было сообщить о случае лечения алиментарной лимфомы В-клеточного лимфобластного типа у кошек с помощью инъекций гомеопатического препарата Viscum album. Наблюдалось полное разрешение опухолевых проявлений, а также животное прожило намного дальше, в отличие от случаев, описанных в литературе. Введение Гематопоэтические опухоли считаются наиболее распространенными среди домашних кошек [1-5], составляя треть всех опухолей у кошек. Они могут быть системными или мультицентрическими и поражать разные ткани [5]. В число возможных причин возникновения этого заболевания входят такие вирусы, как вирус лейкоза кошек (FeLV) [6,7] и вирус иммунодефицита кошек (FIV) [8]. Только 25% кошек с лимфомой положительны на FeLV, и около 20% кошек, у которых развивается лимфома в США, являются серопозитивными по антителам против FIV [8,9]. Доказательств породной или половой предрасположенности нет. Однако некоторые авторы утверждают, что кастрированные самцы несколько чаще болеют лимфомой, особенно алиментарного типа [3]. Средний возраст пациентов с диагнозом лимфома составляет от 8 до 10 лет [2,10]. Обычно алиментарные лимфомы встречается у кошек в возрасте от 10 до 12 лет, отрицательных на FeLV [9]. Это наиболее диагностируемый тип среди различных типов лимфомы, на который приходится около 50% случаев [11]. В этом контексте алиментарную лимфому определяют как лимфоидную неоплазию, которая поражает желудочно-кишечный тракт и регионарные лимфатические узлы, обычно поражая тонкий кишечник, печень и селезенку [9]. Это считается вторым по распространенности новообразованием, обнаруживаемым в желудочно-кишечном тракте кошек [12]. Оно встречается у 50% кошек с диагнозом лимфома [5]. Этот тип неоплазии может проявляться двумя картинами: лимфоцитарным, также называемым мелкоклеточным или малодифференцированным, и лимфобластным, также называемым крупноклеточным или высокодифференцированным, который может распространяться за пределы желудочно-кишечного тракта, достигая периферических, грудных и костномозговых лимфатических узлов [10]. 13]. Лимфобластная лимфома часто связана с более тяжелыми и острыми симптомами, которые способствуют быстрому началу и прогрессированию. Почти 80% кошек с этой неоплазией будут иметь некоторые пальпируемые отклонения в животе, которые могут представлять собой образование, утолщение петель кишечника, сопровождающееся нарушениями в работе или спленомегалией [14]. Эта неоплазия обычно начинается в пищеварительной системе кошек и быстро распространяется на другие органы и системы. Она редко дает значительный ответ на лечение [14]. Наиболее распространенным типом клеток при лимфоцитарных лимфомах являются Т-клетки, тогда как В-клетки чаще встречаются в лимфобластных [15]. У больных кошек обычно наблюдается анорексия, значительная потеря веса и более высокая вероятность возникновения инвагинации, обструктивных образований и септического перитонита, приводящего к перфорации. Кошки с лимфобластной лимфомой могут иметь или не иметь в анамнезе рвоту и диарею [3]. Диагностика алиментарной лимфомы осуществляется на основании анамнеза, физического осмотра, лабораторных и визуализирующих тестов, аспирационной цитологии, биопсии и иммуногистохимии [3]. Лечение состоит из протоколов химиотерапии, обычно с комбинированными лекарственными средствами, без доказательств того, что предшествующее хирургическое удаление опухоли более эффективно, чем одна химиотерапия, за исключением случаев, когда имеется масса, полностью или частично препятствующая транзиту пищи по кишечнику[10]. Однако противоопухолевые препараты вызывают различные токсические эффекты, особенно в отношении паренхимы печени [16]. Родаски и др. [17] сообщили, что гепатотоксичность химиотерапевтических препаратов обычно совпадает с увеличением уровня сывороточных ферментов, таких как аланинаминотрансфераза (АЛТ) и щелочная фосфатаза (АР) [17,18]. Миелотоксичность — еще один частый и серьезный лимитирующий фактор химиотерапии, снижающий эффективность лечения и увеличивающий вероятность метастазирования [19-21]. В этом контексте дополнительные методы лечения приобретают все большее значение как в качестве основного, так и в качестве дополнительного лечения онкологических больных, поскольку они не вызывают побочных эффектов и стимулируют иммунную систему, улучшая качество жизни и, следовательно, увеличивая выживаемость пациентов [2]. Viscum album (VA) — наиболее часто используемое растение в мире в качестве дополнительной терапии при онкологии. Его применяют либо в фитотерапевтической, либо в гомеопатической форме, и оног проявляет избирательное цитотоксичное действие только в отношении опухолевых клеток, но не в отношении нормальных клеток [23], а также из-за его иммуномодулирующего и противовоспалительного действия [22]. Валле и др. [24] описывают селективную цитотоксичность in vitro ультраразбавленных экстрактов VA при добавлении к культурам клеток аденокарциномы молочной железы и мезенхимальных стволовых клеток. Цитотоксическая активность этого лекарства была как минимум в пять раз выше в клетках аденокарциномы, чем в нормальных клетках, что позволяет предположить более высокое избирательное действие препарата на опухолевые клетки. Кирш [25] сообщает о случае, когда он использовал экстракт VA (Iscador® M) в качестве единственного средства для дополнительного послеоперационного лечения метастатической меланомы. Он обнаружил, что лечение было чрезвычайно эффективным и очень хорошо переносимым у этого пациента, что привело к полной ремиссии неоплазии. Лефевр [26] применял VA одновременно с традиционной химиотерапией у собак и заметил, что это лечение сокращают общее время лечения, уменьшая побочные эффекты химиотерапии, такие как лейкопения. Валле и др. [27] также описали успешное лечение трансмиссивных венерических опухолей с использованием потенцированного VA. Поэтому целью данной работы было сообщить о случае домашней кошки с диагнозом лимфобластная лимфома, иммунофенотип типа В, которую лечили ультраразбавленными препаратами VA и магнезия фосфорика, и у которой наблюдалась ремиссия заболевания. Материалы и методы 11-летний самец кошки сиамской породы (рис. 1) весом 3,8 кг поступил в ветеринарную клинику UNIP в феврале 2016 года. В течение трех недель у животного наблюдались потеря веса, апатия, отсутствие аппетита, постоянные приступы рвоты и боли в животе. При физикальном обследовании животное показало обезвоживание на 4 %, сильную боль при пальпации живота, нормальные слизистые оболочки, температуру 38oC, аускультацию сердца, соответствующую возрасту и виду, слегка увеличенную частоту дыхания, лимфатические узлы стандартного размера и консистенции для возраста и вида. Лабораторные анализы (общий анализ крови, мочевина, креатинин, АЛТ и щелочная фосфатаза), анализы на FIV/FeLV, УЗИ брюшной полости, эндоскопия пищеварительного тракта, биопсия и иммуногистохимия были запрошены.
 Рисунок 1: Пациент. Кот, 11 лет, сиамская порода.
Рисунок 1: Пациент. Кот, 11 лет, сиамская порода.
Результаты При лабораторных исследованиях не было выявлено никаких изменений, заслуживающих внимания. Большинство показателей находились в пределах нормы для данного возраста и вида. Только креатинин был изменен, что подтверждает ранее поставленный диагноз хронической болезни почек (креатинин 2,45 мг/дл). Тесты на FIV/FeLV были отрицательными. При ультразвуковом исследовании в желудке, в области дна (рис. 2a и 2b), было обнаружено образование, вызывающее акустическую тень. Затем животное было направлено на эндоскопию желудка, в результате которой было обнаружено образование размером около 4,6 см (рис. 3д) и связанная с ним изъязвленная область (рис. 3е). В результате биопсии был обнаружен плазматический инфильтрат (рис. 4). Иммуногистохимический анализ показал экспрессию CD79a, в то время как экспрессия AE1AE3, MUM1, CD3, триптазы и C-Kit не была обнаружена. Таким образом, было сделано заключение, что иммуногистохимический и морфологический профили исследуемого фрагмента позволяют поставить диагноз лимфобластной лимфомы иммунофенотипа B. Было выбрано инъекционное гомеопатическое лечение, главным образом потому, что оно просто в обращении и не имеет побочных эффектов для пациента. Использовался Viscum album в различных потенциях, таких как D3, D6, D9, D12, D30, которые ежедневно вводились в подкожных комбинациях, SID (непонятная и нигде в тексте не объясненная аббревиатура), в следующем порядке: 1-й день - VA D3 + VA D6; 2-й день - VA D9 + VAD 12; 3-й день - VA D30 + VA D3, и Magnesia phosphorica D35, одна ампула, подкожно, SID. Оба препарата применялись в течение 122 дней подряд.
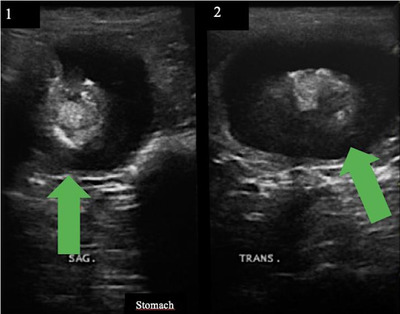 Рисунок 2: (а) УЗИ желудка (сагиттальный срез) показывает образование диаметром около 3,6 см, обозначенное зеленой стрелкой; (б) УЗИ желудка (поперечный срез) показывает образование диаметром около 4,9 см.
Рисунок 2: (а) УЗИ желудка (сагиттальный срез) показывает образование диаметром около 3,6 см, обозначенное зеленой стрелкой; (б) УЗИ желудка (поперечный срез) показывает образование диаметром около 4,9 см.
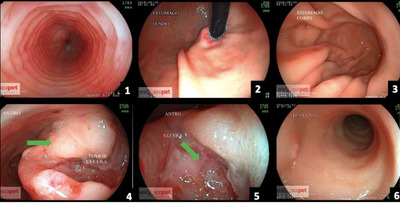 Рисунок 3: (a) Пищевод; (b) Желудок (дно); (c) Желудок (тело); (d) Опухоль желудка (антрум) - изъязвленное опухолевое поражение; (e) Желудок - изъязвленная область антрума; (f) Двенадцатиперстная кишка.
Рисунок 3: (a) Пищевод; (b) Желудок (дно); (c) Желудок (тело); (d) Опухоль желудка (антрум) - изъязвленное опухолевое поражение; (e) Желудок - изъязвленная область антрума; (f) Двенадцатиперстная кишка.
 Рисунок 4: увеличение в 40 раз - видны инфильтраты плазматических клеток.
Рисунок 4: увеличение в 40 раз - видны инфильтраты плазматических клеток.
Куратор кота сообщил, что животное начало спонтанно есть уже в первую неделю после начала лечения. Куратор также сообщил, что боль уменьшилась после третьего применения предложенных препаратов. Дальнейшая оценка с помощью визуализационных тестов была проведена через 122 дня. Снова было проведено УЗИ брюшной полости (рис. 5), и изменений, визуализированных ранее, не наблюдалось. Было зафиксировано следующее наблюдение: стенка желудка находилась в пределах нормы (0,23 см), при этом никаких ультразвуковых признаков отклонений при этом исследовании не было. На изображениях, полученных при эндоскопии (рис. 6), желудок имел чистую и прозрачную слизистую оболочку, сохраненную форму и архитектуру. Слизистая оболочка, бороздки слизистой и тело желудка имели типичную форму и особенности при эндоскопической макроскопии. Между телом и антрум-каналом на левой стенке имелся небольшой сидячий полип (рис. 6d и 6e). Поверхность антрумного канала была гладкой и слегка гиперемированной. При предыдущем осмотре пролиферации тканей не выявлено. Двенадцатиперстная кишка сохранила форму и размер, а бархатистая слизистая имела светло-розовый цвет. Для гистопатологического исследования был взят новый фрагмент из того же ранее травмированного участка, в котором были обнаружены интраэпителиальные гранулярные лимфоциты, незлокачественный лимфоплазмоцитарный инфильтрат (рис. 7). Животное находилось под наблюдением до момента смерти из-за заболевания почек, предшествовавшего лечению лимфомы. Смерть наступила через 24 месяца после лечения, без признаков, совместимых с рецидивом лимфомы.
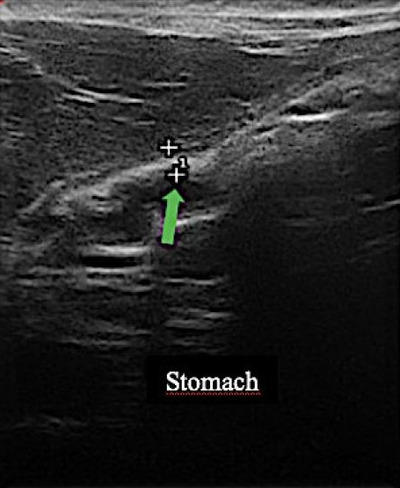 Рисунок 5: Толщина стенки желудка (0,23), указанная зеленой стрелкой, в пределах нормы для возраста и вида.
Рисунок 5: Толщина стенки желудка (0,23), указанная зеленой стрелкой, в пределах нормы для возраста и вида.
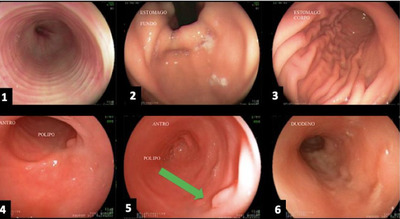 Рисунок 6: (a) Пищевод; (b) Желудок (дно); (c) Желудок (тело); (d) и (e) Желудок (антрум) с наличием полипа, указанного зеленой стрелкой; (f) Двенадцатиперстная кишка.
Рисунок 6: (a) Пищевод; (b) Желудок (дно); (c) Желудок (тело); (d) и (e) Желудок (антрум) с наличием полипа, указанного зеленой стрелкой; (f) Двенадцатиперстная кишка.
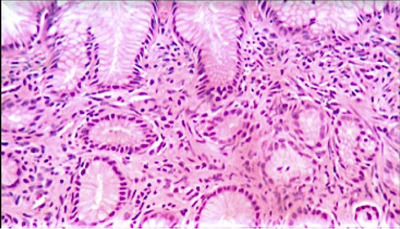 Рисунок 7: 40-кратное изображение - инфильтрат из лимфоплазмоцитов.
Рисунок 7: 40-кратное изображение - инфильтрат из лимфоплазмоцитов.
Обсуждение Лимфома является одной из наиболее частых гемопоэтических неоплазий у домашних кошек [12]. У кошек алиментарная лимфома составляет около 50 % всех случаев лимфомы и считается злокачественным новообразованием, наиболее отзывчивым на химиотерапию [28]. Однако при этом отмечается ряд побочных эффектов, описанных ранее. Алиментарная лимфома является одним из наиболее распространенных новообразований в онкологии кошек, поскольку это относительно агрессивная опухоль и в большинстве случаев трудно поддается лечению [9]. Рабочая формула Национального института рака (NCIWF) классифицировала алиментарную лимфому кошек на высокую, промежуточную и низкую степени, причем последняя обычно затрагивает диффузную форму заболевания и была первым описанным типом. Менее описанной формой является лимфома из крупных гранулярных лимфоцитарных клеток, которая подразделяется на иммунобластную и лимфобластную [29]. Представленный случай подтверждает данные Birchard [14] и характеризуется более тяжелыми и острыми клиническими признаками, а также быстрым началом и прогрессированием, что соответствует 80% кошек с данной неоплазией. Однако, в отличие от Birchard [14], у исследуемого животного поражение наблюдалось в области дна желудка, а не в кишечнике. Поэтому в данном исследовании не было отмечено утолщения кишечных петель или гепатоспленомегалии. По данным Pohlman et al. [30], алиментарная лимфома поражает желудок, тонкую и толстую кишку в 24, 74 и 16 % случаев соответственно. Данный случай находится в пределах 24 % случаев, поражающих область желудка. Продолжительность жизни большинства кошек с лимфомой составляет от шести до девяти месяцев при лечении несколькими химиотерапевтическими препаратами, связанными или не связанными с хирургическим или лучевым лечением. Примерно 20 % животных выживают более года. Прогноз для FeLV-позитивных кошек хуже и выживаемость составляет три-четыре месяца. FeLV-отрицательные кошки выживают дольше, чем FeLV-положительные, достигая 9-18 месяцев жизни, в зависимости от места поражения [31]. В отличие от работы Amorim [31], в данном исследовании описано разрешение кошачьей алиментарной лимфомы в течение четырех месяцев. Также сообщается о выживании животного в течение 24 месяцев, без появления клинических признаков, совместимых с первоначальной патологией, и без применения химиотерапевтических препаратов. Пациента лечили с помощью инъекционных гомеопатических препаратов для иммуномодуляции организма и создания селективной цитотоксической активности [23,24] посредством ультраразбавленного препарата VA. Для лечения микроокружения опухоли также назначалась инъекционная и ультраразбавленная Magnesia phosphorica. Данный протокол подтвердил эффективность нетрадиционной терапии в лечении лимфомы желудка и показал отличные результаты, такие как минимальная инвазивность, отсутствие побочных эффектов и низкая стоимость по сравнению с терапией выбора для лечения этого заболевания. Основным прогностическим фактором является первоначальный ответ на химиотерапию и наступление ремиссии. Кошки с хорошим первоначальным ответом на химиотерапевтическое лечение и полной ремиссией обычно живут в среднем один год. Однако в данном случае описывается лечение с использованием инъекционной гомеопатии, при котором пациент продемонстрировал отличный ответ, с ремиссией опухолевой массы, без побочных эффектов и с восстановлением здоровья за 122 дня. Кроме того, животное прожило 28 месяцев до момента публикации данного отчета. Выводы В заключение следует отметить, что данный случай предлагает еще один вариант успешного лечения кошачьей лимфомы желудка, который не вызывает побочных эффектов у пациента, является минимально инвазивным и недорогим по сравнению с традиционными методами лечения. Однако необходимо провести дополнительные исследования, чтобы лучше выяснить механизм действия этого класса лекарств. Список литературы 1. COURT EA, WATSON ADJ, PEASTON AE (1997) Retrospective study of 60 cases of feline lymphosarcoma. Australian Veterinary Journal 75: 424-427. [crossref] 2. GABOR LJ, MALIK R, CANFIELD PJ (1998) Clinical and anatomical features of lymphossarcoma in 118 cats. Australian Veterinary Journal 76: 725-732. [crossref] 3. NORSWORTHY GD, GRACE SF, CRYSTAL MA, TILLEY LP (2011) The feline patient. 4. ed. Iowa: Wiley – Blackwell. 1073 p. 4. STÜTZER, B Karin Simon, Hans Lutz, Monir Majzoub, Walter Hermanns, et al. (2011) Incidence of persistent viraemia and latent feline leukaemia virus infection in cats with lymphoma. J Feline Med Surg 13: 81-87. [crossref] 5. WOLDEMESKEL M (2020) Primary Cardiac Lymphoma in a Cat. J Comp Pathol 174: 34-38. 6. HARTMANN K (2012) Feline leukemie virus infection. In C. E. Greene (Ed.), Infections dieseases of the dog and cat. Missouri, USA: Elsevier. 7. LUTZ H, ADDIE D, BELÁK S, BOUCRAUT-BARALON C, EGBERINK H, et al. (2009) Feline leukaemia. ABCD guidelines on prevention and management. Journal of Feline Medicine & Surgery 11: 565-574. [crossref] 8. COTTER SM, HARDY JUNIORR WD, ESSEX M (1975) Association of feline leukemia virus with lymphosarcoma and other disorders in the cat. Journal of the American Veterinary Medical Association 166: 449-454. [crossref] 9. BADO AS (2011) Alimentary lymphoma in cats. Undergraduate thesis (Undergraduation in Veterinary Medicine) – Universidade Federal do Rio Grande do Sul, Porto Alegre, Brazil. 38p. 10. WILSON HM (2008) Feline Alimentary Lymphoma: Demystifying the Enigma. Topics in companion animal medicine 23: 177-184. [crossref] 11. COUTO CG (2000) Advances in the treatment of the cat with lymphoma in practice. Journal of Feline Medicine and Surgery 2: 95-100. [crossref] 12. ORTIZ BC, SOARES CA, GOMES VR, SECCHI P, SCHULZ JÚNIOR FJ, et al. (2019) Lymphocytic alimentary lymphoma in a feline: therapy with lomustine and prednisone – Case report. Pubvet 13: 1-5. 13. MORRIS J, DOBSON J (2001) Small animal oncology. Londres: Blackwell science. 315. 14. BIRCHARD SJ (2008) Saunders Manual: small animal practice. 3. ed. Sao Paulo: Roca. 2048. 15. PATTERSON-KANE JC, KUGLER BP, FRANCIS K (2004) The possible prognostic significance of immunophenotype in feline alimentary lymphoma: a pilot study. J Comp Pathol 130: 220-222. [crossref] 16. BERGER C, HUG M, GYSIN C MOLINARI L, FREI M, BOSSART W, et al. (2007) Distribution patterns of beta- and gamma-herpesviruses within Waldeyer’s ring organs. Med. Virol 79: 1147-1152. [crossref] 17. RODASKI S, WERNER J (2008) Skin neoplasia. In: DALECK, C.R., DE NARDI, A.B., RODASKI S (Eds) Oncology in dogs and cats. Sao Paulo: Roca. 253-279. 18. ARAUJO GG (2009) Feline lymphoma. 45 p. Undergraduate thesis (Undergraduation in Veterinary Medicine) – Universidade Federal do Rio Grande do Sul, Porto Alegre, Brazil. 19. HERNANDEZ L, PINYOL M, HERNANDEZ S, BEA S, PULFORD K, et al. (1999) TRK-fused gene (TFG) is a new partner of ALK in anaplastic large cell 9 lymphoma producing two structurally different TFG-ALK translocations. Blood 94: 3265-3268. 20. NELSON RW, COUTO CG Small Animal Internal Medicine. 4th ed. Rio de Janeiro: Elsevier. 1468. 21. LANORE D, DELPRAT C (2004) Anticancer chemotherapy. São Paulo: Roca. 53-78. 22. Rostock M. (2020) Die Misteltherapie in der Behandlung von Patienten mit einer Krebserkrankung [Mistletoe in the treatment of cancer patients]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 63: 535-540. 23. CARVALHO AC (2015) Antineoplastic activity of Viscum album (L) in experimental tumors: a critical review and experimental study in Ehrlich tumor. Doctorate Dissertation in Environmental and Experimental Universidade Paulista. 24. VALLE ACV, LIMA L, BONAMIN L, BRUNEL H, BARROS A, et al. (2020) Use of Viscum album in the Integrative Treatment of Cholangiocarcinoma in a Dog (Canis familiaris) – Case Report. Adv Complement Alt Med 5: 476-481. 25. KIRSCH A (2007) Successful treatment of metastatic malignant melanoma with Viscum album extract (Iscador M). J Altern Complement Med 13: 443-445. [crossref] 26. LEFEBVRE GNF, BONAMIN LV, OLIVEIRA CM (2007) Treatment of canine transmissible venereal tumor (TVT) using Viscum album in combination with chemotherapy. Revista Clinica Veterinária 12: 78-86. 27. VALLE ACV, SIBATA MN, ANDRADE RV, CARVALHO AC (2019) Homeopathy for the Treatment of Transmissible Venereal Tumor (TVT) in a Mixed-Breed Female Dog. Adv Complement Alt Med 5: 422-424. 28. LIPP VB (2008) Lymphsarcome in dogs Undergraduate thesis. Faculty of Veterinary Medicine, Universidade Federal do Rio Grande do Sul, Porto Alegre, Brazil. 29. LINGARD AE, BRISCOE K, BEATTY JA, MOORE AS, CROWLEY AM, et al. (2009) Low-grade alimentary lymphoma: clinicopathological findings and response to treatment in 17 cases. Journal of Feline Medicine and Surgery 11: 692-700. [crossref] 30. POHLMAN L, HIGGINBOTHAM ML, WELLES E, JOHNSON C (2009) Immunophenotypic and Histologic Classification of 50 Cases of Feline Gastrointestinal Lymphoma. Veterinary pathology 46: 259-268. [crossref] 31. AMORIM FV, ANDRADE VV, SOUZA HJM, FERREIRA AMR (2006) Meadistinal lymphona in cats – case report. Clínica Veterinária São Paulo 63: 68-74. Источник: https://researchopenworld.com/treatment-of-alimentary-lymphoma-in-cat-felis-catus-by-injectable-homeopathy-case-report/ | |
| Просмотров: 358 | |
